Aufnahme 1
Meningeom
Klinik:
37-jähriger Patient mit Schmerzen der rechten Gesichtshälfte und einer Hörminderung des rechten Ohrs seit 2 Monaten.
Untersuchung/Befund:
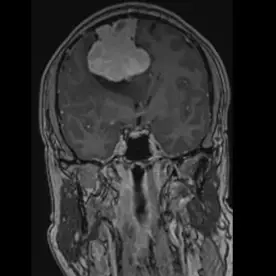
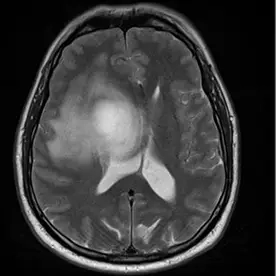
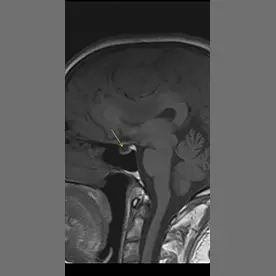
Es zeigt sich eine ausgedehnte Raumforderung des Kleinhirnbrückenwinkels rechts mit einem sogenannten "dural tail sign" (Bild 10-1, Pfeil). Die Raumforderung zeigt ein Wachstum nach intrameatal rechts (Bild 10-2, Pfeil) und entlang des Foramen ovale (Bild 10-3, Pfeil). Es zeigt sich ein ausgeprägtes verdrängendes Wachstum ohne Perifokalödem (Bild 10-4). Insgesamt passt dieses Bild zu einem Meningiom.
Beurteilung:
Typisches Bild eines Meningioms
Epidemiologie
Meningiome treten häufiger bei Frauen auf, mit einem Verhältnis von 2:1 intrakraniell und 4:1 an der Wirbelsäule. Atypische und bösartige Meningiome sind bei Männern etwas häufiger anzutreffen. Sie sind bei Patienten vor dem 40. Lebensjahr selten. Bei jüngeren Patient:innen besteht differentialdiagnostisch der Verdacht auf Neurofibromatose Typ 2.
Pathologie/Labor:
Man geht davon aus, dass Meningeome aus Meningozyten oder Arachnoidalkappenzellen entstehen, die ihrerseits aus pluripotenten mesenchymalen Vorläuferzellen hervorgehen, was die ungewöhnliche Lage der primären extraduralen Tumoren erklärt.
Obwohl die Mehrzahl der Tumoren sporadisch auftritt, werden sie auch bei vorangegangener kranialer Bestrahlung und natürlich bei Patienten mit Neurofibromatose Typ II (Merlin-Gen auf Chromosom 22) beobachtet. Außerdem reagieren Meningiome empfindlich auf Östrogen und Progesteron und können während der Schwangerschaft wachsen.
Im Gegensatz zu anderen Tumoren wurden die Begriffe "atypisch" und "anaplastisch"/"maligne" als histologische Subtypen mit Grad 2 bzw. Grad 3 beibehalten.
Ansonsten werden Meningeome auf der Grundlage histologischer Merkmale (z. B. Mitoseindex), einiger histologischer Subtypen (z. B. chordoide Meningeome und klarzellige Meningeome) und molekularer Merkmale (siehe unten) in Grade 1 bis 3 eingeteilt.
In der 5. Auflage (2021) der WHO-Klassifikation der ZNS-Tumoren werden insgesamt 15 Subtypen von Meningeomen unterschieden:
- Angiomatöses Meningeom
- Atypisches Meningiom: Grad 2
- Anaplastisches (bösartiges) Meningeom: Grad 3
- Chordoides Meningeom: Grad 2
- Klarzelliges Meningeom: Grad 2
- Faseriges Meningeom (7%)
- Lymphoplasmazytose-reiches Meningiom
- Meningotheliales Meningiom (17%)
- Metaplastisches Meningiom
- Mikrozystisches Meningeom
- Papilläres Meningiom: in der Regel aggressiveres Verhalten
- Psammomatöses Meningeom
- Rhabdoides Meningiom: in der Regel aggressiveres Verhalten
- Sekretorisches Meningeom
- Übergangsmeningeom (40%): gemischte Histologie, die typischerweise meningotheliale und fibröse Komponenten enthält
Zunehmend werden molekulare Marker in die Diagnose und Einstufung von Meningiom-Subtypen einbezogen, die bei der Differenzierung helfen können:
- SMARCE1-Mutationen: klarzelliger Subtyp
- BAP1-Mutationen: papilläre und rhabdoide Subtypen
- KLF4/TRAF7-Mutationen: sekretorischer Subtyp
- TERT-Promotor-Mutation: Grad 3
- homozygote Deletion von CDKN2A/B: Grad 3
- H3K27me3-Verlust der Kernexpression: schlechtere Prognose
- Methylom-Profilierung: prognostische Subtypisierung
Radiologisch „typische“ Merkmale:
- Liquorspaltzeichen, das nicht spezifisch für Meningiome ist, aber dazu beiträgt, die Masse als extraaxial einzustufen; ein Verlust dieses Zeichens kann bei Grad II und Grad III beobachtet werden, was auf eine Invasion des Hirnparenchyms hindeuten kann
- „Dural tail sign“ ist in 60-72 % zu sehen (cave: ein dural tail sign kann auch bei anderen Pathologien vorkommen!)
- „Sun burst-“ oder „spoke wheel-sign“ der Gefäße
- Buckling-sign in der weißen Substanz
- Arterienverengung: typischerweise bei Meningiomen, die Arterien umschließen / nützliches Zeichen bei parasellären Tumoren, um ein Meningiom von einem Hypophysenadenom zu unterscheiden; letzteres verengt die Gefäße in der Regel nicht
Therapie/Prognose:
Die Behandlung erfolgt in der Regel durch chirurgische Resektion. Wenn nur eine unvollständige Resektion möglich ist (insbesondere an der Schädelbasis), kann eine externe Strahlentherapie (oder sogar Brachytherapie) eingesetzt werde. Die Bestrahlung verbessert nachweislich die lokale Behandlung und verlängert die Gesamtüberlebenszeit.
Keine weit verbreitete chemotherapeutische/systemische Therapie hat sich als wirksam erwiesen, obwohl einige mTOR-Inhibitoren und antiangiogene Behandlungen vielversprechend erscheinen.
Der Simpson-Grad korreliert den Grad der Vollständigkeit der chirurgischen Resektion mit der symptomatischen Rezidivrate, die ebenfalls je nach Grad und Dauer der Nachbeobachtung variiert. Eine metastatische Erkrankung ist extrem selten.
Differentialdiagnose:
Zu den wichtigsten zu berücksichtigenden duralen Massen gehören:
- solitäre fibröse Tumore der Dura aggressiver, oft Knochen zerstörend/ ausgedehnte periphere Vaskularität/stärkere Mikrolobulation
- Durale Metastasen (z. B. Brustkrebs)
Lokalisation abhängige Differentialdiagnosen können sein:
- Kleinhirn-Pontin-Winkel: Akustisches Schwannom
- Hypophysenregion: Hypophysenmakroadenom/Kraniopharyngiom
- Schädelbasis: hypertrophe Pachymeningitis/extramedulläre Hämatopoese/ Chondrosarkom/ Chordom
Differentialdiagnose einer Hyperostose:
- Paget-Krankheit
- Fibröse Dysplasie
- Osteoblastische Metastasen (z. B. Prostata- und Mammakarzinom)
Literatur
- Robert I. Grossman, David M. Yousem. Neuroradiology. (2003) ISBN: 9780323005081
- Wallace E. The Dural Tail Sign. Radiology. 2004;233(1):56-57.
- Elster A, Challa V, Gilbert T, Richardson D, Contento J. Meningiomas: MR and Histopathologic Features. Radiology. 1989;170(3 Pt 1):857-62.
- Filippi CG, Edgar MA, Uluğ AM et-al. Appearance of meningiomas on diffusion-weighted images: correlating diffusion constants with histopathologic findings. AJNR Am J Neuroradiol. 2001;22 (1): 65-72.
- Agrawal V, Ludwig N, Agrawal A, Bulsara K. Intraosseous Intracranial Meningioma. AJNR Am J Neuroradiol. 2007;28(2):314-5.
- Lee W, Chang K, Choe G et al. MR Imaging Features of Clear-Cell Meningioma with Diffuse Leptomeningeal Seeding. AJNR Am J Neuroradiol. 2000;21(1):130-2.
- Louis D, Ohgaki H, Wiestler O et al. The 2007 WHO Classification of Tumours of the Central Nervous System. Acta Neuropathol. 2007;114(2):97-109.
- Harry S. Greenberg, William F. Chandler, Howard M. Sandler. Brain Tumors. (1999) ISBN: 9780195129588 -
- Siegelman E, Mishkin M, Taveras J. Past, Present, and Future of Radiology of Meningioma. Radiographics. 1991;11(5):899-910.
- Ginsberg L. Radiology of Meningiomas. J Neurooncol. 1996;29(3):229-38.
- Backer-Grøndahl T, Moen B, Torp S. The Histopathological Spectrum of Human Meningiomas. Int J Clin Exp Pathol. 2012;5(3):231-42.
- Matsushima N, Maeda M, Takamura M, Matsubara T, Taki W, Takeda K. MRI Findings of Atypical Meningioma with Microcystic Changes. J Neurooncol. 2006;82(3):319-321.
- Jörg-Christian Tonn, Manfred Westphal, J. T. Rutka. Oncology of CNS Tumors. (2010) ISBN: 9783642028731
- Sanverdi S, Ozgen B, Oguz K et al. Is Diffusion-Weighted Imaging Useful in Grading and Differentiating Histopathological Subtypes of Meningiomas? Eur J Radiol. 2012;81(9):2389-2395.
- Santelli L, Ramondo G, Della Puppa A et al. Diffusion-Weighted Imaging Does Not Predict Histological Grading in Meningiomas. Acta Neurochir. 2010;152(8):1315-1319.
- Ding Y, Wang H, Tang K, Hu Z, Jin W, Yan W. Expression of Vascular Endothelial Growth Factor in Human Meningiomas and Peritumoral Brain Areas. Ann Clin Lab Sci. 2008;38(4):344-51.
- Tokgoz N, Oner Y, Kaymaz M, Ucar M, Yilmaz G, Tali T. Primary Intraosseous Meningioma: CT and MRI Appearance. AJNR Am J Neuroradiol. 2005;26(8):2053-6.
- Kalamarides M, Stemmer-Rachamimov A, Niwa-Kawakita M et al. Identification of a Progenitor Cell of Origin Capable of Generating Diverse Meningioma Histological Subtypes. Oncogene. 2011;30(20):2333-2344.
- Parizel P, Carpentier K, Van Marck V et al. Pneumosinus Dilatans in Anterior Skull Base Meningiomas. Neuroradiology. 2012;55(3):307-311.
- Smith A, Horkanyne-Szakaly I, Schroeder J, Rushing E. From the Radiologic Pathology Archives: Mass Lesions of the Dura: Beyond Meningioma—Radiologic-Pathologic Correlation. Radiographics. 2014;34(2):295-312.
- Joung H. Lee. Meningiomas. (2009) ISBN: 9781848829107
- Kim B, Kim M, Kim S, Chang C, Kim O. Peritumoral Brain Edema in Meningiomas : Correlation of Radiologic and Pathologic Features. J Korean Neurosurg Soc. 2011;49(1):26.
- Regelsberger J, Hagel C, Emami P, Ries T, Heese O, Westphal M. Secretory Meningiomas: A Benign Subgroup Causing Life-Threatening Complications. Neuro Oncol. 2009;11(6):819-824.
- Carli D, Sluzewski M, Beute G, van Rooij W. Complications of Particle Embolization of Meningiomas: Frequency, Risk Factors, and Outcome: Fig 1. AJNR Am J Neuroradiol. 2009;31(1):152-154.
- Huang S, Chen L, Mao Y, Tong H. Primary Pulmonary Meningioma. Medicine. 2017;96(19):e6474.
- Tamrazi B, Shiroishi M, Liu C. Advanced Imaging of Intracranial Meningiomas. Neurosurg Clin N Am. 2016;27(2):137-143.
- Nicosia L, Di Pietro S, Catapano M et al. Petroclival Meningiomas: Radiological Features Essential for Surgeons. ecancer. 2019;13.
- Yamada K, Kizu O, Nishimura T. MR Tractography for Minimally Invasive Neurosurgery. SpringerLink. :58-68.
- Mendenhall W, Friedman W, Amdur R, Foote K. Management of Benign Skull Base Meningiomas: A Review. Skull Base. 2004;14(1):53-60.
- Tang H, Sun H, Chen H et al. Clinicopathological Analysis of Metaplastic Meningioma: Report of 15 Cases in Huashan Hospital. Chin J Cancer Res. 2013;25(1):112-8.
- Sahm F, Perry A, Deimling A, Claus EB, Mawrin C, Brastianos PK, Santagata S, Meningioma. In: WHO Classification of Tumours Editorial Board. Central nervous system tumours. Lyon (France): International Agency for Research on Cancer; 2021. . (WHO classification of tumours series, 5th ed.; vol. 6).
- The Definition and Role of Brain Invasion in Meningioma Grading: Still Controversial After All These Years. Free Neuropathology. 2:8.
- Walcott BP, Nahed BV, Brastianos PK et-al. Radiation Treatment for WHO Grade II and III Meningiomas. Front Oncol. 2013;3: 227.
- Maggio I, Franceschi E, Tosoni A et al. Meningioma: Not Always a Benign Tumor. A Review of Advances in the Treatment of Meningiomas. CNS Oncology. 2021;10(2):CNS72.